a) So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau.
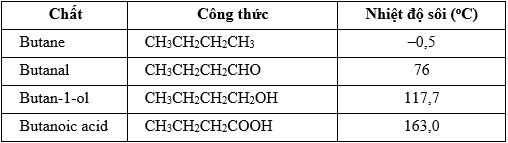
Giải thích.
b) Vì sao acetic acid tan vô hạn trong nước?
c) Hãy sắp xếp theo chiều tăng dần nhiệt độ sôi của các chất sau: (1) C3H8, (2) C2H5COOH, (3) C2H5CHO, (4) C3H7OH. Giải thích tại sao sắp xếp như vậy.
-
-
-
-
Đáp án đúng:
1.
Nhiệt độ sôi của butanoic acid lớn hơn nhiệt độ sôi của các chất trong bảng, do liên kết O-H trong nhóm carboxyl phân cực hơn liên kết O-H trong alcohol, dẫn đến liên kết hydrogen giữa các phân tử carboxylic acid bền vững hơn so với liên kết hydrogen hình thành giữa các phân tử alcohol.
2.
Acetic acid (CH3COOH) là carboxylic acid mạch ngắn, có phân tử khối nhỏ và có khả năng tạo liên kết hydrogen với nước nên tan vô hạn trong nước.
3.
Nhiệt độ sôi của các hợp chất hữu cơ có cùng số nguyên tử C: hydrocarbon < carbonyl < alcohol < carboxylic acid.
(2) và (4) đều có liên kết hydrogen, nhưng liên kết hydrogen trong (2) bền hơn nên (2) có nhiệt độ sôi lớn hơn, trong khi (1) và (3) không có liên kết hydrogen.
Chất nào có phân tử khối lớn thì nhiệt độ sôi lớn hơn, nên (1) < (3)
Nên nhiệt độ sôi (1) < (3) < (4) < (2)
Số bình luận về đáp án: 0
2.
Acetic acid (CH3COOH) là carboxylic acid mạch ngắn, có phân tử khối nhỏ và có khả năng tạo liên kết hydrogen với nước nên tan vô hạn trong nước. 3.
Nhiệt độ sôi của các hợp chất hữu cơ có cùng số nguyên tử C: hydrocarbon < carbonyl < alcohol < carboxylic acid.
(2) và (4) đều có liên kết hydrogen, nhưng liên kết hydrogen trong (2) bền hơn nên (2) có nhiệt độ sôi lớn hơn, trong khi (1) và (3) không có liên kết hydrogen.
Chất nào có phân tử khối lớn thì nhiệt độ sôi lớn hơn, nên (1) < (3) Nên nhiệt độ sôi (1) < (3) < (4) < (2)