a) Tính ΔHo của phản ứng giữa N2H4(l) và H2O2(l) với phản ứng hóa học xảy ra như sau:
N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(g).
Biết một số giá trị enthalpy tạo thành chuẩn được cho trong bảng sau:

b) Tính ΔH0 của phản ứng giữa N2H4(l) và H2O2(l) nếu dựa vào các dữ kiện nhiệt động sau:
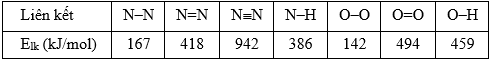
Trong 2 kết quả tìm được ở trên, kết quả nào chính xác hơn? Tại sao?
-
-
-
-
Đáp án đúng:
HD: a) Phản ứng: N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(g);
ΔHocách (1) = [4 × (– 241,6) + 0] – [2 × (– 187,8) + 1 × 50,6] = – 641,4 kJ.
b) ΔHocách (2) = (4 × EN–H + EN–N) + 2 × (2 × EO–H + EO–O) – EN≡N – 4 × (2 × EO–H) = – 783kJ.
⇒ Kết quả tính theo cách (1) chính xác hơn cách (2) vì năng lượng liên kết chỉ là các giá trị trung bình.
Số bình luận về đáp án: 16
ΔHocách (1) = [4 × (– 241,6) + 0] – [2 × (– 187,8) + 1 × 50,6] = – 641,4 kJ.
b) ΔHocách (2) = (4 × EN–H + EN–N) + 2 × (2 × EO–H + EO–O) – EN≡N – 4 × (2 × EO–H) = – 783kJ.
⇒ Kết quả tính theo cách (1) chính xác hơn cách (2) vì năng lượng liên kết chỉ là các giá trị trung bình.