Cho các phương trình nhiệt hóa học sau:
(1) 2C(graphite) + 3H2(g) → C2H6(g) ∆rH°298(1) = -84,7 kJ
(2) C(graphite) + O2(g) → CO2(g) ∆rH°298(2) = -393,5 kJ
(3) H2(g) + O2(g) → H2O(l) ∆rH°298(3) = -285,8 kJ
(4) C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(l) ∆rH°298(4) = ? kJ
Hãy tính biến thiên enthalpy chuẩn của phản ứng (4).
-
-
-
-
Đáp án đúng:
(4) C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(l) ∆rH°298(4) = ? kJ
Biến thiên chuẩn của phản ứng:
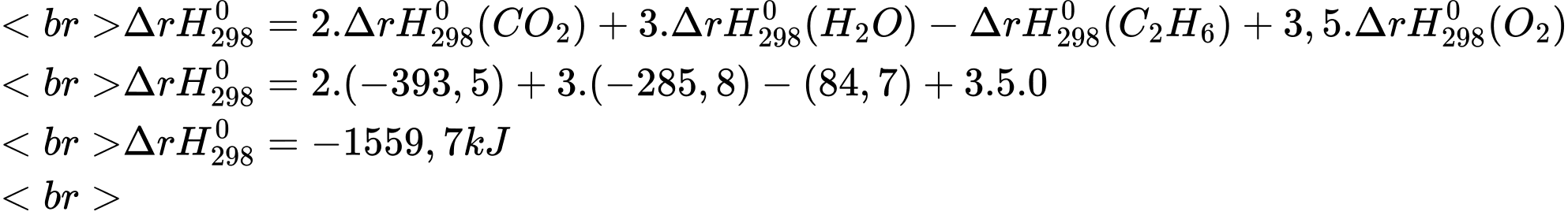 Số bình luận về đáp án: 7
Số bình luận về đáp án: 7
Biến thiên chuẩn của phản ứng: