Có thể theo dõi tốc độ phản ứng giữa zinc và hydrochloric acid bằng cách đo thể tích khí hydrogen thoát ra trong phản ứng:
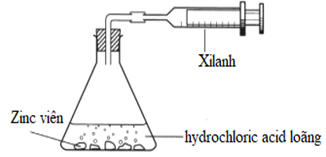
Hình 6.7. Sơ đồ thí nghiệm quá trình đo khí hydrogen thoát ra từ phản ứng của Zn và HCl
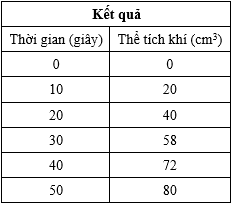
a) Tính tốc độ trung bình của khí thoát ra (cm3/s) trong 40 giây đầu của phản ứng.
b) Tại sao tăng nồng độ acid sẽ làm tốc độ của phản ứng tăng?
-
-
-
-
Đáp án đúng:
HD: a) Phản ứng xảy ra:
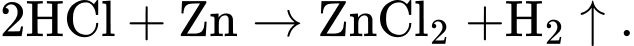
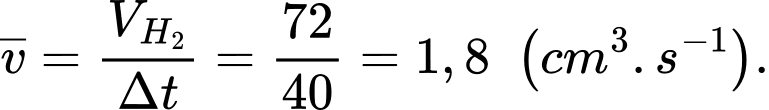
b) Khi nồng độ axit tăng, số va chạm giữa Zn và HCl tăng
⇒ va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.
Số bình luận về đáp án: 2
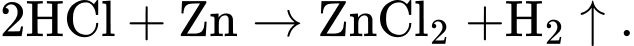
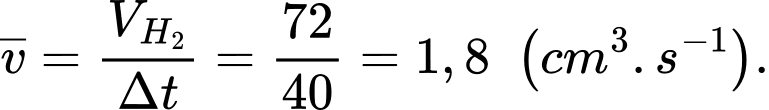
b) Khi nồng độ axit tăng, số va chạm giữa Zn và HCl tăng
⇒ va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.