Để xác định hàm lượng manganese và choromium trong một mẫu thép, người ta oxi hóa hoàn toàn 5 gam mẫu thép trên, khi đó manganese chuyển thành  và chromium chuyển thành
và chromium chuyển thành  . Sau quá trình xử lí, thu được 100 mL dung dịch X, chia X thành hai phần bằng nhau:
. Sau quá trình xử lí, thu được 100 mL dung dịch X, chia X thành hai phần bằng nhau:
- Lấy 50 mL dung dịch X rồi thêm dung dịch BaCl2 vào, điều chỉnh pH để chromium kết tủa hoàn toàn dưới dạng BaCrO4 thì thu được 5,28 gam kết tủa.
- Để chuẩn độ  có trong 50 mL dung dịch X trong môi trường acid thì cần dung 43,5 mL dung dịch Fe2+ 1,6M.
có trong 50 mL dung dịch X trong môi trường acid thì cần dung 43,5 mL dung dịch Fe2+ 1,6M.
a) Viết các phương trình hóa học xảy ra dạng ion.
b) Tính thành phần phần trăm khối lượng Mn, Cr có trong mẫu thép trên.
-
-
-
-
Đáp án đúng:
Phần 1: Cr2 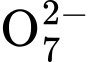 + H2O
+ H2O 
 + 2H+
+ 2H+
Ba2+ + 
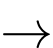 BaCrO4
BaCrO4
Số mol BaCrO4: 12/575 mol
mCr = 624/575 gam
%mCr = [2.(624/575) : 5].100% = 43,41%
Phần 2:
Số mol Fe2+: 0,0696 mol.
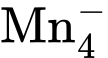 + 8H+ + 5Fe2+
+ 8H+ + 5Fe2+ 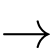 5Fe3+ + Mn2+ + 4H2O
5Fe3+ + Mn2+ + 4H2O
Cr2 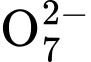 + 14H+ 6Fe3+ + 2Cr3+ + 7H2O
+ 14H+ 6Fe3+ + 2Cr3+ + 7H2O
Số mol 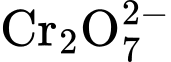 = 1/2 mol BaCrO4 = 6/575
= 1/2 mol BaCrO4 = 6/575
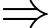 Số mol Fe2+(2) = 36/575 mol = 0,0626.
Số mol Fe2+(2) = 36/575 mol = 0,0626.
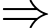 Số mol Fe2+(1) = 6,99.10–3 mol
Số mol Fe2+(1) = 6,99.10–3 mol
số mol  = (1/5).6,99.10–3 mol
= (1/5).6,99.10–3 mol
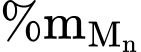 = [(1/5).6,99.10–3.55.2.100%)] : 5 = 3,076%.
Số bình luận về đáp án: 0
= [(1/5).6,99.10–3.55.2.100%)] : 5 = 3,076%.
Số bình luận về đáp án: 0
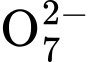 + H2O
+ H2O 
 + 2H+
+ 2H+
Ba2+ +

 BaCrO4
BaCrO4
Số mol BaCrO4: 12/575 mol
mCr = 624/575 gam
%mCr = [2.(624/575) : 5].100% = 43,41%
Phần 2:
Số mol Fe2+: 0,0696 mol.
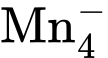 + 8H+ + 5Fe2+
+ 8H+ + 5Fe2+  5Fe3+ + Mn2+ + 4H2O
5Fe3+ + Mn2+ + 4H2O
Cr2
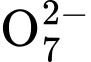 + 14H+ 6Fe3+ + 2Cr3+ + 7H2O
+ 14H+ 6Fe3+ + 2Cr3+ + 7H2O
Số mol
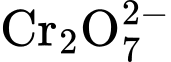 = 1/2 mol BaCrO4 = 6/575
= 1/2 mol BaCrO4 = 6/575
 Số mol Fe2+(2) = 36/575 mol = 0,0626.
Số mol Fe2+(2) = 36/575 mol = 0,0626.
 Số mol Fe2+(1) = 6,99.10–3 mol
Số mol Fe2+(1) = 6,99.10–3 mol
số mol
 = (1/5).6,99.10–3 mol
= (1/5).6,99.10–3 mol
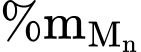 = [(1/5).6,99.10–3.55.2.100%)] : 5 = 3,076%.
= [(1/5).6,99.10–3.55.2.100%)] : 5 = 3,076%.