Điện phân dung dịch chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1 : 3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2,68A. Sau thời gian điện phân t (giờ), thu được dung dịch Y (chứa hai chất tan) có khối lượng giảm 10,375 gam so với dung dịch ban đầu. Dung dịch Y phản ứng vừa hết với 2,55 gam Al2O3. Giá trị của t gần nhất với giá trị nào sau đây?
-
-
-
-
Đáp án đúng: D
Giải: Vì 2nCuSO4 < nNaCl ⇒ Al2O3 bị hòa tan bởi OH–.
Ta có nAl2O3 = 0,025 mol ⇒ nOH– cần dùng = 0,05 mol.
⇒ nNaOH = 0,05 mol.
Vì Dung dịch chỉ chứa 2 chất tan ⇒ Cl– đã bị điện phân hết và 2 chất tan đó là Na2SO4 và NaOH.
⇒ mGiảm = mCu + mCl– + mH2
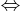 mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375
mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375
⇒ Nước có điện phân (10,375 – 8,575) = 1,8 gam ⇒ nH2O = 0,1 mol.
⇒ ∑ne nhận = 2nCu + 2nH2 + 2nH2O = 0,1 + 0,05 + 0,2 = 0,35 mol.
⇒ t = 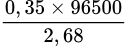 ≈ 12602,6s ≈ 3,5 giờ ⇒ Chọn D
≈ 12602,6s ≈ 3,5 giờ ⇒ Chọn D
Số bình luận về đáp án: 16
Ta có nAl2O3 = 0,025 mol ⇒ nOH– cần dùng = 0,05 mol.
⇒ nNaOH = 0,05 mol.
Vì Dung dịch chỉ chứa 2 chất tan ⇒ Cl– đã bị điện phân hết và 2 chất tan đó là Na2SO4 và NaOH.
⇒ mGiảm = mCu + mCl– + mH2
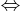 mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375
mGiảm = 0,05×64 + 0,15×35,5 + 0,05×1 = 8,575 < 10,375⇒ Nước có điện phân (10,375 – 8,575) = 1,8 gam ⇒ nH2O = 0,1 mol.
⇒ ∑ne nhận = 2nCu + 2nH2 + 2nH2O = 0,1 + 0,05 + 0,2 = 0,35 mol.
⇒ t =
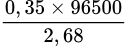 ≈ 12602,6s ≈ 3,5 giờ ⇒ Chọn D
≈ 12602,6s ≈ 3,5 giờ ⇒ Chọn D