Đốt cháy hoàn toàn một lượng C2H5OH(l) ở 298K, áp suất 1,0 bar với 1,000 mol khí oxygen, thu được CO2(g), H2O(l) và giải phóng lượng nhiệt là 343 kJ.
a) Tính số mol C2H5OH(l) đã phản ứng, biết rằng sau phản ứng còn dư 0,250 mol oxygen(g).
b) Tính biến thiên enthalpy của phản ứng đốt cháy C2H5OH(l) ở 298K.
-
-
-
-
Đáp án đúng:
a) Số mol khí oxygen đãphản ứng là: 1 – 0,250 = 0,75 (mol)
C2H5OH(l) + 3O2(g)  2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l)
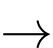 Số mol C2H5OH(l) đã phản ứng là: 0,75.1/3 = 0,25 (mol)
Số mol C2H5OH(l) đã phản ứng là: 0,75.1/3 = 0,25 (mol)
b) Đốt cháy 0,25 mol C2H5OH(l) giải phóng dung lượng nhiệt là 343 kJ.
1 mol C2H5OH(l) giải phóng dung lượng nhiệt là x kJ.
 x = 1.343/0,25 = 1372 (kJ)
x = 1.343/0,25 = 1372 (kJ)
biến thiên enthalpy của phản ứng đốt cháy C2H5OH(l) ở 298K là  Số bình luận về đáp án: 0
Số bình luận về đáp án: 0
C2H5OH(l) + 3O2(g)
 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l)
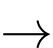 Số mol C2H5OH(l) đã phản ứng là: 0,75.1/3 = 0,25 (mol)
Số mol C2H5OH(l) đã phản ứng là: 0,75.1/3 = 0,25 (mol)
b) Đốt cháy 0,25 mol C2H5OH(l) giải phóng dung lượng nhiệt là 343 kJ.
1 mol C2H5OH(l) giải phóng dung lượng nhiệt là x kJ.
 x = 1.343/0,25 = 1372 (kJ)
x = 1.343/0,25 = 1372 (kJ)
biến thiên enthalpy của phản ứng đốt cháy C2H5OH(l) ở 298K là
