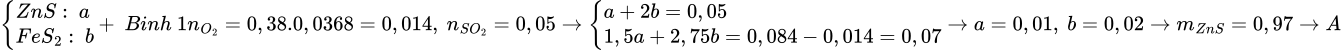Hai bình kín (1), (2) đều có dung tích không đổi 9,96 lít chứa không khí (21% oxi và 79% nitơ về thể tích) ở 27,30C và 752,4 mmHg. Cho vào cả hai bình những lượng như nhau hỗn hợp ZnS và FeS2. Trong bình (2) còn thêm một ít bột lưu huỳnh (không dư). Sau khi nung bình để đốt cháy hết hỗn hợp sunfua và lưu huỳnh, đưa nhiệt độ 136,50C, lúc đó trong bình (1) áp suất P1 và oxi chiếm 3,68% thể tích, trong bình (2) áp suất là P2 và nitơ chiếm 83,16% thể tích. Tính % thể tích khí SO2, khối lượng ZnS đã cho vào trong mỗi bình và áp suất trong hai bình (1) là:
-
-
-
-
Đáp án đúng: A
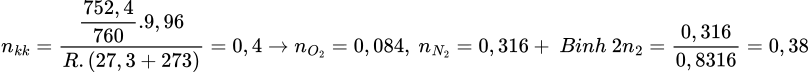
Cho vào bình 2 thêm 1 ít S thì lượng khí của 2 bình vẫn là như nhau vì 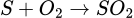 , lượng khí SO2 trong bình 2 nhiều hơn bình 1
, lượng khí SO2 trong bình 2 nhiều hơn bình 1
Áp suất trong 2 bình là 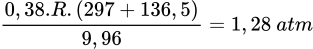
Ta thấy lượng N2 ở 2 bình là như nhau, lượng khí ở 2 bình là như nhau nên ở bình 1 N2 cũng chiếm 83,16% -> SO2 chiếm: 100-83,16-3,68=13,16%
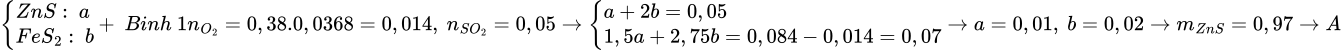
Số bình luận về đáp án: 8
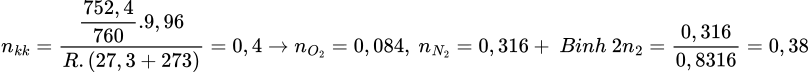
Cho vào bình 2 thêm 1 ít S thì lượng khí của 2 bình vẫn là như nhau vì
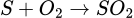 , lượng khí SO2 trong bình 2 nhiều hơn bình 1
, lượng khí SO2 trong bình 2 nhiều hơn bình 1Áp suất trong 2 bình là
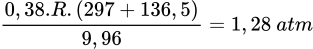
Ta thấy lượng N2 ở 2 bình là như nhau, lượng khí ở 2 bình là như nhau nên ở bình 1 N2 cũng chiếm 83,16% -> SO2 chiếm: 100-83,16-3,68=13,16%