Hòa tan hoàn toàn hỗn hợp X gồm Fe(NO3)2, Fe3O4, MgO, Mg (oxi chiếm 29,68% theo khối lượng) trong dung dịch 9,22 mol HCl loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 463,15 gam muối clorua và 29,12 lít (đktc) khí Z gồm NO và H2 có tỉ khối so với H2 là 69/13. Thêm NaOH dư vào dung dịch Y, sau phản ứng thấy xuất hiện kết tủa T. Nung T trong không khí đến khối lượng không đổi được 204,4 gam chất rắn M. Phần trăm khối lượng MgO trong X là giá trị nào sau đây?
-
-
-
-
Đáp án đúng: A
Giải: 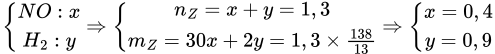
● Đặt mX = m ⇒ nO/X = 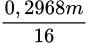 mol || Bảo toàn Oxi: nH2O = (
mol || Bảo toàn Oxi: nH2O = (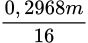 – 0,4) mol.
– 0,4) mol.
BTKL: m + 9,22 × 36,5 = 463,15 + 1,3 × 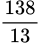 + 18 × (
+ 18 × (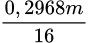 – 0,4).
– 0,4).
⇒ m = 200 gam ⇒ nH2O = 3,31 mol || Bảo toàn Hidro: nNH4+ = 0,2 mol.
Bảo toàn Nitơ: nFe(NO3)2 = 0,3 mol ||● Đặt nFe3O4 = a; nMgO = b; nMg = c.
nO/X = 3,71 mol = 0,3 × 6 + 4a + b || mX = 0,3 × 180 + 232a + 40b + 24c = 200 gam.
mM = mFe2O3 + mMgO = 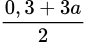 × 160 + 40 × (a + b) = 204,4 gam.
× 160 + 40 × (a + b) = 204,4 gam.
||⇒ giải hệ cho: a = 0,3 mol; b = 0,71 mol; c = 2 mol ⇒ %mMgO = 14,2% ⇒ chọn A.
Số bình luận về đáp án: 0
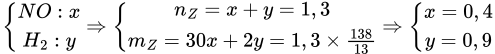
● Đặt mX = m ⇒ nO/X =
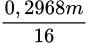 mol || Bảo toàn Oxi: nH2O = (
mol || Bảo toàn Oxi: nH2O = (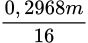 – 0,4) mol.
– 0,4) mol.BTKL: m + 9,22 × 36,5 = 463,15 + 1,3 ×
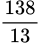 + 18 × (
+ 18 × (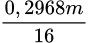 – 0,4).
– 0,4).⇒ m = 200 gam ⇒ nH2O = 3,31 mol || Bảo toàn Hidro: nNH4+ = 0,2 mol.
Bảo toàn Nitơ: nFe(NO3)2 = 0,3 mol ||● Đặt nFe3O4 = a; nMgO = b; nMg = c.
nO/X = 3,71 mol = 0,3 × 6 + 4a + b || mX = 0,3 × 180 + 232a + 40b + 24c = 200 gam.
mM = mFe2O3 + mMgO =
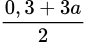 × 160 + 40 × (a + b) = 204,4 gam.
× 160 + 40 × (a + b) = 204,4 gam.||⇒ giải hệ cho: a = 0,3 mol; b = 0,71 mol; c = 2 mol ⇒ %mMgO = 14,2% ⇒ chọn A.