Phương trình phản ứng giữa ion bromate và ion bromide trong môi trường acid như sau:
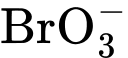 (aq) + 5Br(aq) + 6H+(aq)
(aq) + 5Br(aq) + 6H+(aq)  3Br2(l) + 3H2O(l)
3Br2(l) + 3H2O(l)
Từ thực nghiệm, tốc độ của phản ứng là 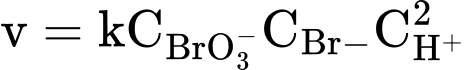 . Tốc độ của phản ứng sẽ thay đổi như thế nào khi thay đổi nồng độ của các ion như sau:
. Tốc độ của phản ứng sẽ thay đổi như thế nào khi thay đổi nồng độ của các ion như sau:
a) tăng 2 lần nồng độ của 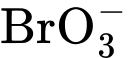 và giữ nguyên nồng độ của Br– và H+?
và giữ nguyên nồng độ của Br– và H+?
b) tăng 2 lần nồng độ của 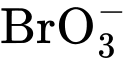 , H+ và giữ nguyên nồng độ của Br–?
, H+ và giữ nguyên nồng độ của Br–?
c) giảm 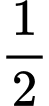 nồng độ của H+, tăng 2 lần nồng độ của Br–, giữ nguyên nồng độ của
nồng độ của H+, tăng 2 lần nồng độ của Br–, giữ nguyên nồng độ của 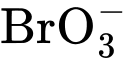 ?
?
-
-
-
-
Đáp án đúng:
Ta có: 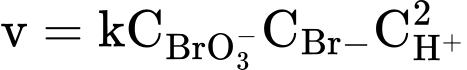
Gọi x, y, z lần lượt là nồng độ ban đầu của ion 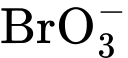 , Br–, H+
, Br–, H+
 v = k.x.y.z2
v = k.x.y.z2
a) Tăng 2 lần nồng độ của 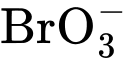
 nồng độ của
nồng độ của 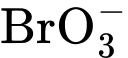 là 2x
là 2x
 v1 = k.2x.y.z2 = 2v
v1 = k.2x.y.z2 = 2v  Tốc độ phản ứng tăng gấp đôi.
Tốc độ phản ứng tăng gấp đôi.
b) Tăng 2 lần nồng độ của 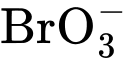 , H+
, H+  nồng độ của
nồng độ của 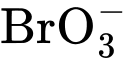 là 2x
là 2x
Nồng độ của H+ là 2z
 v2 = k.2x.y.(2z)2 = 8v
v2 = k.2x.y.(2z)2 = 8v  Tốc độ phản ứng tăng 8 lần.
Tốc độ phản ứng tăng 8 lần.
c) Giảm một nửa nồng độ của H+, tăng 2 lần nồng độ của Br–
 nồng độ của H+ là
nồng độ của H+ là 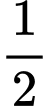 z; nồng độ của Br– là 2y
z; nồng độ của Br– là 2y
 v3 = k.x.2y.
v3 = k.x.2y.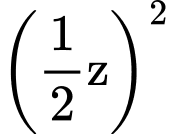 =
= 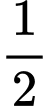 v
v  Tốc độ phản ứng giảm một nửa.
Số bình luận về đáp án: 0
Tốc độ phản ứng giảm một nửa.
Số bình luận về đáp án: 0
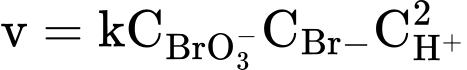
Gọi x, y, z lần lượt là nồng độ ban đầu của ion
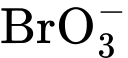 , Br–, H+
, Br–, H+
 v = k.x.y.z2
v = k.x.y.z2
a) Tăng 2 lần nồng độ của
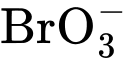
 nồng độ của
nồng độ của 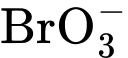 là 2x
là 2x
 v1 = k.2x.y.z2 = 2v
v1 = k.2x.y.z2 = 2v  Tốc độ phản ứng tăng gấp đôi.
Tốc độ phản ứng tăng gấp đôi.
b) Tăng 2 lần nồng độ của
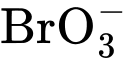 , H+
, H+  nồng độ của
nồng độ của 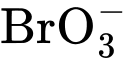 là 2x
là 2x
Nồng độ của H+ là 2z
 v2 = k.2x.y.(2z)2 = 8v
v2 = k.2x.y.(2z)2 = 8v  Tốc độ phản ứng tăng 8 lần.
Tốc độ phản ứng tăng 8 lần.
c) Giảm một nửa nồng độ của H+, tăng 2 lần nồng độ của Br–
 nồng độ của H+ là
nồng độ của H+ là 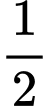 z; nồng độ của Br– là 2y
z; nồng độ của Br– là 2y
 v3 = k.x.2y.
v3 = k.x.2y.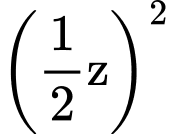 =
= 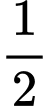 v
v  Tốc độ phản ứng giảm một nửa.
Tốc độ phản ứng giảm một nửa.