So sánh bán kính nguyên tử và ion sau: Mg ; O2- ; S ; P ; K+ ; Al3+
-
-
-
-
Đáp án đúng: C
HD: trong một chu kì thì bán kính nguyên tử giảm dần ( nhớ = cách phi kim bán kính < kim loại ).
Do đó: 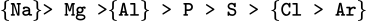
Trong một nhóm, từ trên xuống bán kính tăng dần nên: 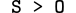
Chú ý thêm những nguyên tố trong {} là những nhân tố phụ để giải quyết vấn đề.
Hãy để ý những nguyên tố có cùng số e thì điện tích hạt nhân càng lớn thì bán kính nguyên tử càng nhỏ ( do càng + càng hút e mạnh → r càng nhỏ ).
Nên: Ar > K+; S > O > O2- > Al3+.
Tạm thời có: 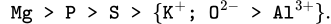
Như vậy thì công việc khó khăn nhất của chúng ta giờ chỉ là so sánh 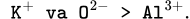
Chú ý rằng K+ có 3 lớp e còn 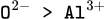 chỉ có 2 lớp e nên rõ ràng bán kính của K+ phải lớn hơn.
chỉ có 2 lớp e nên rõ ràng bán kính của K+ phải lớn hơn.
Vậy có: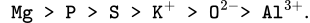
Ta chọn đáp án C.♣♣♣
Số bình luận về đáp án: 2
Do đó:
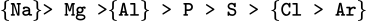
Trong một nhóm, từ trên xuống bán kính tăng dần nên:
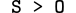
Chú ý thêm những nguyên tố trong {} là những nhân tố phụ để giải quyết vấn đề.
Hãy để ý những nguyên tố có cùng số e thì điện tích hạt nhân càng lớn thì bán kính nguyên tử càng nhỏ ( do càng + càng hút e mạnh → r càng nhỏ ).
Nên: Ar > K+; S > O > O2- > Al3+.
Tạm thời có:
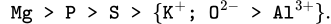
Như vậy thì công việc khó khăn nhất của chúng ta giờ chỉ là so sánh
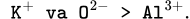
Chú ý rằng K+ có 3 lớp e còn
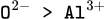 chỉ có 2 lớp e nên rõ ràng bán kính của K+ phải lớn hơn.
chỉ có 2 lớp e nên rõ ràng bán kính của K+ phải lớn hơn.Vậy có:
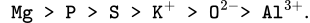
Ta chọn đáp án C.♣♣♣