Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và một oxit sắt FexOy (trong điều kiện không có không khí) thu được 92,35 gam chất rắn Y. Hòa tan Y trong dung dịch NaOH (dư) thấy có 8,4 lít khí H2 (ở đktc) thoát ra và còn lại phần không tan Z. Hòa tan ½ lượng Z bằng dung dịch H2SO4 đặc, nóng (dư) thấy có 13,44 lít khí SO2 (ở đktc) thoát ra. Biết các phản ứng xảy ra hoàn toàn. Khối lượng Al2O3 trong Y và công thức oxit sắt lần lượt là
-
-
-
-
Đáp án đúng: C
HD • Nhiệt nhôm Al, FexOy → 92,35 gam rắn Y: Al2O3; Fe; có thể có Al hoặc oxit sắt dư
Rắn Y + NaOHdư → 0,375 mol H2 + rắn Z
→ Al dư; FexOy hết
1/2Z + H2SO4 đặc → 0,6 mol SO2
• 2Aldư + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
nAldư = 2/3 × nH2 = 2/3 × 0,375 = 0,25 mol → mAldư = 0,25 × 27 = 6,75 gam.
• Fe + H2SO3 → SO2
Theo bảo toàn electron 3 × nFe = 2 × nSO2 → nFe = 2/3 × nSO2 = 2/3 × 0,6 = 0,4 mol
→ mFe = 0,4 × 56 = 22,4 gam
• mY = mAl2O3 + mFe + mAl dư → mAl2O3 = 92,35 - 6,75 - 22,4 × 2 = 40,8 gam
→ nAl2O3 = 40,8 : 102 = 0,4 mol.
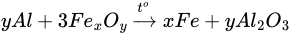
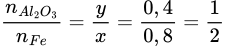 → Oxit sắt là Fe2O3 → Đáp án đúng là đáp án C
→ Oxit sắt là Fe2O3 → Đáp án đúng là đáp án C
Số bình luận về đáp án: 12
Rắn Y + NaOHdư → 0,375 mol H2 + rắn Z
→ Al dư; FexOy hết
1/2Z + H2SO4 đặc → 0,6 mol SO2
• 2Aldư + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
nAldư = 2/3 × nH2 = 2/3 × 0,375 = 0,25 mol → mAldư = 0,25 × 27 = 6,75 gam.
• Fe + H2SO3 → SO2
Theo bảo toàn electron 3 × nFe = 2 × nSO2 → nFe = 2/3 × nSO2 = 2/3 × 0,6 = 0,4 mol
→ mFe = 0,4 × 56 = 22,4 gam
• mY = mAl2O3 + mFe + mAl dư → mAl2O3 = 92,35 - 6,75 - 22,4 × 2 = 40,8 gam
→ nAl2O3 = 40,8 : 102 = 0,4 mol.
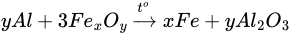
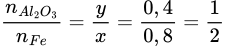 → Oxit sắt là Fe2O3 → Đáp án đúng là đáp án C
→ Oxit sắt là Fe2O3 → Đáp án đúng là đáp án C