Tiến hành lên men giấm 100ml dung dịch C2H5OH 460 với hiệu suất 50% thì thu được dung dịch X. Đun nóng X (giải sử chỉ xẩy ra phản ứng este hóa) đến trạng thái cân bằng thu được 17,6 gam este. Giả sử thể tích dung dịch không thay đổi. Tính hằng số cân bằng của phản ứng este hóa? (biết 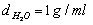 ,
, 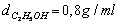 )
)
-
-
-
-
Đáp án đúng: C
Trong 100 ml dung dịch C2H5OH 460 chứa 46ml C2H5OH nguyên chất và 54ml nước
→ mC2H5OH = 46. 0,8 = 36,8 gam → nC2H5OH = 0,8 mol
Có mH2O ( trong dd rượu) = 54. 1= 54 gam → nH2O (trong dd rượu) = 3 mol
Phương trình phản ứng : C2H5OH + O2 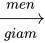 CH3COOH + H2O (1)
CH3COOH + H2O (1)
Với H = 50% → nCH3COOH =nH2O (1) = 0,8. 0,5 = 0,4 mol
Phương trình este hóa: C2H5OH + CH3COOH  CH3COOC2H5 + H2O (2)
CH3COOC2H5 + H2O (2)
Có nCH3COOC2H5 = 0,2 mol → [CH3COOC2H5] = 2 M
Chú ý : ∑nH2O = nH2O (trong dd rượu) + nH2O (1) + nH2O (2) = 3 + 0,4 + 0,2 = 3,6 mol → [H2O]= 36M
Ở trạng thái cân bằng [C2H5OH]=[CH3COOH]= 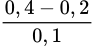 = 2 M
= 2 M
Vậy KC= 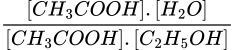 =
= 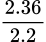 = 18. Đáp án C.
= 18. Đáp án C.
Số bình luận về đáp án: 37
→ mC2H5OH = 46. 0,8 = 36,8 gam → nC2H5OH = 0,8 mol
Có mH2O ( trong dd rượu) = 54. 1= 54 gam → nH2O (trong dd rượu) = 3 mol
Phương trình phản ứng : C2H5OH + O2
 CH3COOH + H2O (1)
CH3COOH + H2O (1)Với H = 50% → nCH3COOH =nH2O (1) = 0,8. 0,5 = 0,4 mol
Phương trình este hóa: C2H5OH + CH3COOH
 CH3COOC2H5 + H2O (2)
CH3COOC2H5 + H2O (2)Có nCH3COOC2H5 = 0,2 mol → [CH3COOC2H5] = 2 M
Chú ý : ∑nH2O = nH2O (trong dd rượu) + nH2O (1) + nH2O (2) = 3 + 0,4 + 0,2 = 3,6 mol → [H2O]= 36M
Ở trạng thái cân bằng [C2H5OH]=[CH3COOH]=
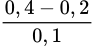 = 2 M
= 2 MVậy KC=
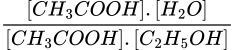 =
= 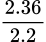 = 18. Đáp án C.
= 18. Đáp án C.