Tiến hành thí nghiệm phân huỷ NO2 ở 300 oC theo phương trình:
2NO2(g) → 2NO(g) + O2(g).
Kết quả thí nghiệm được biểu diễn ở bảng 6.9 sau:
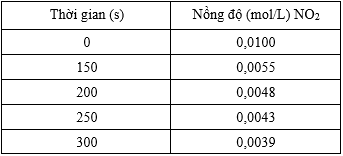
Bảng 6.9. Sự thay đổi nồng độ NO2 theo thời gian
a) Tính tốc độ trung bình của phản ứng theo độ giảm nồng độ của NO2 trong 150 giây đầu tiên và trong các mốc 50 giây tiếp theo.
b) Nhận xét về tốc độ trung bình của phản ứng theo thời gian.
-
-
-
-
Đáp án đúng:
HD: Tốc độ trung bình của phản ứng từ giây 0 đến 150 là:
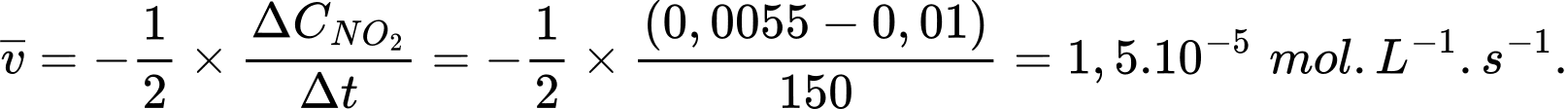
Tốc độ trung bình của phản ứng từ giây 150 đến 200 là:
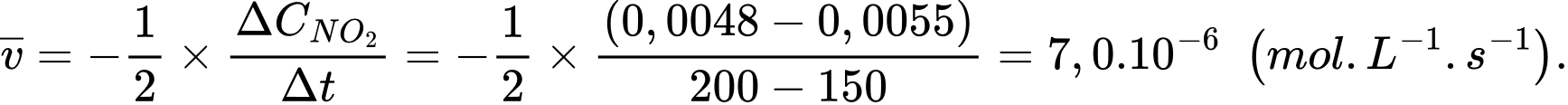
Tốc độ trung bình của phản ứng từ giây 200 đến 250 là
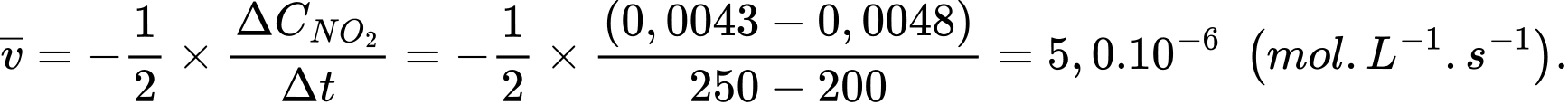
Tốc độ trung bình của phản ứng từ giây 250 đến 300 là
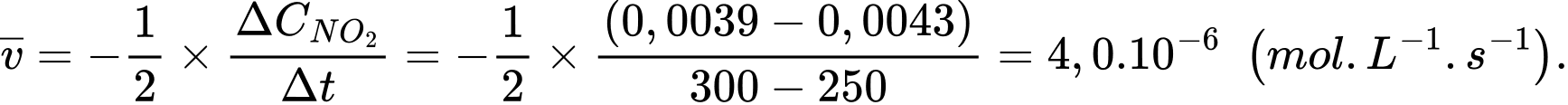
b) Từ kết quả tính được ở câu a ⇒ Nhận xét: tốc độ phản ứng giảm khi thời gian tăng.
Số bình luận về đáp án: 0
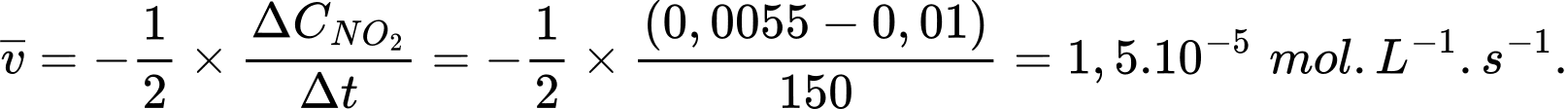
Tốc độ trung bình của phản ứng từ giây 150 đến 200 là:
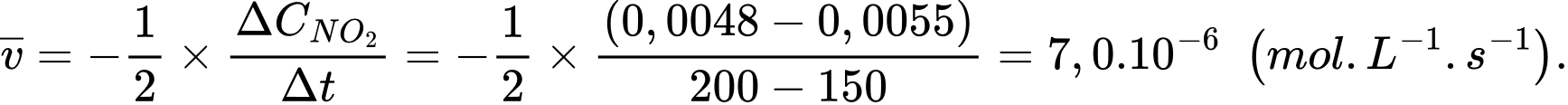
Tốc độ trung bình của phản ứng từ giây 200 đến 250 là
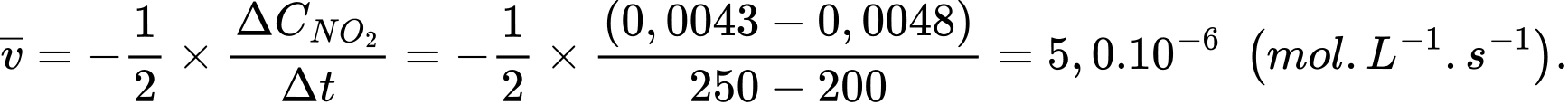
Tốc độ trung bình của phản ứng từ giây 250 đến 300 là
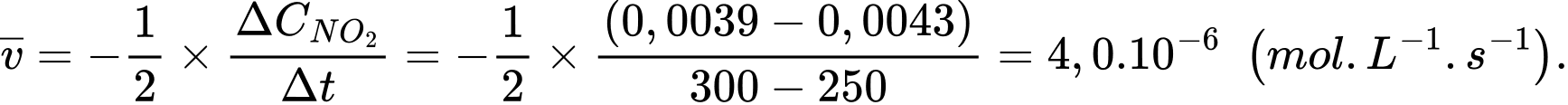
b) Từ kết quả tính được ở câu a ⇒ Nhận xét: tốc độ phản ứng giảm khi thời gian tăng.