Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho khoảng 1 mL 2-iodopropane vào ống nghiệm (1), thêm khoảng 3 mL nước cất rồi lắc đều. Để hỗn hợp tách thành hai lớp, lấy phần trên của hỗn hợp nhỏ vào ống nghiệm có chứa sẵn 1 mL AgNO3. Nếu thấy có kết tủa cần lặp lại đến khi không còn kết tủa (nước rửa không còn ion halogen).
Bước 2: Thêm 2 mL dung dịch NaOH 10% vào ống nghiệm (1). Lắc nhẹ ống nghiệm rồi ngâm vào cốc nước nóng khoảng 5 phút, thỉnh thoảng lắc đều ống nghiệm, để nguội rồi lấy khoảng 1 mL chất lỏng ở phần trên ống nghiệm (1) và chuyển sang ống nghiệm (2).
Bước 3: Trung hoà base dư ở ống nghiệm (2) bằng dung dịch HNO3 loãng (thử bằng giấy quỳ tím) rồi nhỏ thêm vài giọt dung dịch AgNO3 1%, quan sát thấy có kết tủa vàng nhạt xuất hiện.
Trả lời các câu hỏi sau:
a) Vì sao cần đảm bảo nước rửa không còn ion halogen?
b) Tại sao khi thêm dung dịch AgNO3 ở bước 1 không thấy xuất hiện kết tủa mà đến bước 2, sau khi thêm dung dịch AgNO3 vào thì lại thấy xuất hiện kết tủa? Hiện tượng này chứng minh điều gì?
c) Có thể thay thế dung dịch HNO3 bằng dung dịch HCl, H2SO4 được không? Tại sao?
-
-
-
-
Đáp án đúng:
a) Nếu không rửa để loại bỏ ion halogen trong mẫu ban đầu thì ion halogen sinh ra trong phản ứng thuỷ phân lẫn với ion halogen ban đầu, đều tạo thành kết tủa.
Không chứng minh được sự có mặt của ion halogen sinh ra do phản ứng thuỷ phân.
b) Ion halogen trong mẫu đã được loại bỏ ở bước 1, ion halogen trong dẫn xuất không phản ứng trực tiếp với AgNO3 nên mới thêm AgNO3 chưa có kết tủa xuất hiện.
Đến bước 2, dẫn xuất halogen bị thuỷ phân trong NaOH hình thành NaI, NaI phản ứng với AgNO3 sinh ra kết tủa.
Phản ứng
CH3CHICH3 + NaOH 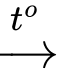 CH3CH(OH)CH3 + NaI
CH3CH(OH)CH3 + NaI
NaI + AgNO3 → AgI + NaNO3
Hiện tượng chứng minh dẫn xuất halogen bị thuỷ phân trong môi trường kiềm.
c) Không thể sử dụng HCl và H2SO4 thay cho HNO3.
Giải thích: HCl và H2SO4 có thể tạo kết tủa với AgNO3 dẫn đến khó quan sát hiện tượng.
HCl(aq) + AgNO3(aq) → AgCl(s) + HNO3(aq)
H2SO4(aq) + 2AgNO3(aq) → Ag2SO4(s) + 2HNO3
Số bình luận về đáp án: 1
Không chứng minh được sự có mặt của ion halogen sinh ra do phản ứng thuỷ phân.
b) Ion halogen trong mẫu đã được loại bỏ ở bước 1, ion halogen trong dẫn xuất không phản ứng trực tiếp với AgNO3 nên mới thêm AgNO3 chưa có kết tủa xuất hiện.
Đến bước 2, dẫn xuất halogen bị thuỷ phân trong NaOH hình thành NaI, NaI phản ứng với AgNO3 sinh ra kết tủa.
Phản ứng
CH3CHICH3 + NaOH
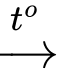 CH3CH(OH)CH3 + NaI
CH3CH(OH)CH3 + NaINaI + AgNO3 → AgI + NaNO3
Hiện tượng chứng minh dẫn xuất halogen bị thuỷ phân trong môi trường kiềm.
c) Không thể sử dụng HCl và H2SO4 thay cho HNO3.
Giải thích: HCl và H2SO4 có thể tạo kết tủa với AgNO3 dẫn đến khó quan sát hiện tượng.
HCl(aq) + AgNO3(aq) → AgCl(s) + HNO3(aq)
H2SO4(aq) + 2AgNO3(aq) → Ag2SO4(s) + 2HNO3