Trinitroglycerin, C3H5N3O9 (thường được gọi là nitroghycerin), là chất lỏng đặc, không màu, sánh như dầu, có khả năng gây nổ và là thành phần chính của thuốc súng không khói. Mặt khác, trinitro-glycerin cũng được sử dụng trong y học với tác dụng làm giảm đau thắt ngực. Ở điều kiện chuẩn, sự phân hủy 1 mol trinitroglycerin tạo thành CO2(g), N2(g), O2(g), H2O(l) và giải phóng lượng nhiệt là 1541,4 kJ.
a) Viết phương trình pahrn ứng phân hủy trinitroglycerin.
b) Tính enthalpy tạo thành chuẩn của trinitroglycerin.
c) Tính lượng nhiệt được giải phóng khi phân hủy hoàn toàn 100 gam trinitroglycerin(l) ở nhiệt độ 25oC và áp suất 1 bar.
Cho biết enthalpy tạo thành chuẩn của CO2(g) và H2O(l) là –393,5 kJ/mol và –285,8 kJ/mol.
-
-
-
-
Đáp án đúng:
a)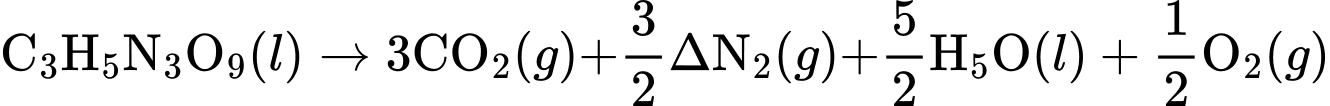
b) Ta có: 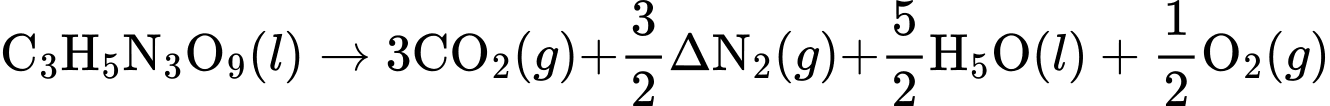
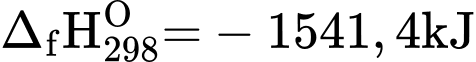
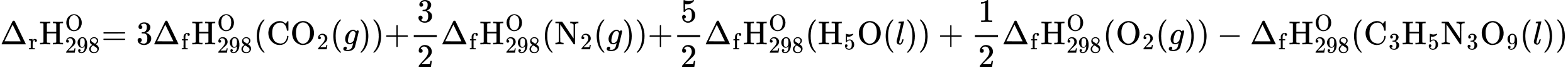
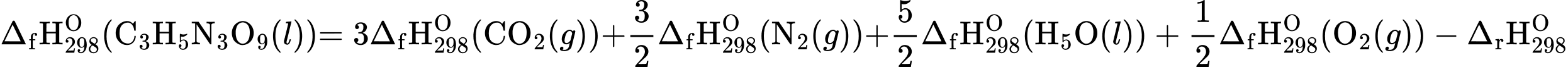
= 3(–393,5)+ 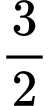 .0 +
.0 + 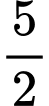 .(–285,8) +
.(–285,8) + 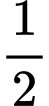 .0 – (– 1841,4) = –353,6 (kJ/mol)
.0 – (– 1841,4) = –353,6 (kJ/mol)
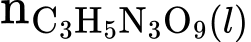 = 100/227 = 0,44 (mol)
= 100/227 = 0,44 (mol)
Lượng nhiệt được giải phóng khi phân hủy 100 gam trinitroglycerin là:
0,44.1541,4 = 678,216 (kJ)
Số bình luận về đáp án: 0
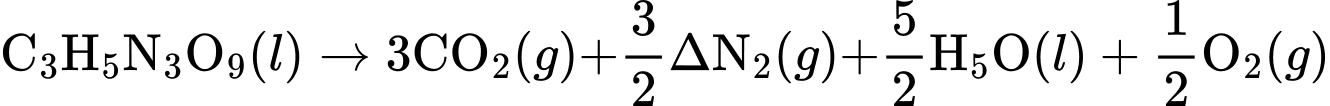
b) Ta có:
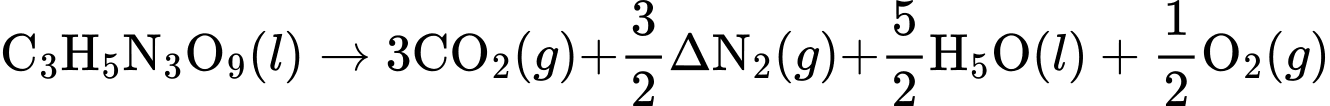
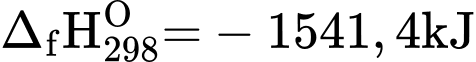
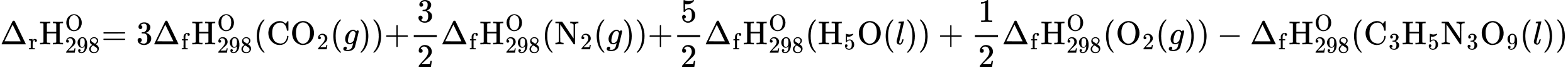
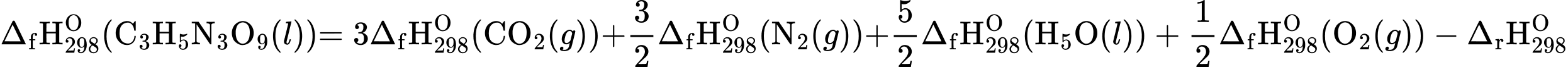
= 3(–393,5)+
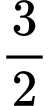 .0 +
.0 + 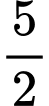 .(–285,8) +
.(–285,8) + 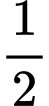 .0 – (– 1841,4) = –353,6 (kJ/mol)
.0 – (– 1841,4) = –353,6 (kJ/mol)
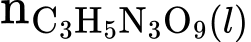 = 100/227 = 0,44 (mol)
= 100/227 = 0,44 (mol)
Lượng nhiệt được giải phóng khi phân hủy 100 gam trinitroglycerin là:
0,44.1541,4 = 678,216 (kJ)