Trộn 25,0ml dung dịch NH3 0,20M với 15,0ml dd HCl 0,20M thì thu được dd có pH là (biết NH3 có Kb=1,8.10-5).
-
-
-
-
Đáp án đúng: A
NH3 + HCl → NH4Cl
Có nHCl = 0,003 mol < nNH3 = 0,005 mol → dung dịch sau phản ứng chứa NH3 dư : 0,005 - 0,003= 0,002 mol → [NH3]dư = 0,002 : ( 0,025 + 0,015) = 0,05 M
Bài toán trở thành tính pH của dung dịch chứa NH3 : 0,05M và NH4Cl : 0,075M.
NH3 + H2O  NH4+ + OH- có Kb = 1,8. 10-5.
NH4+ + OH- có Kb = 1,8. 10-5.
Gọi nồng độ OH- là x →[OH-] = x M, [NH3] = 0,05-x , [NH4+] = x + 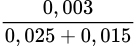 = x+ 0,075 M
= x+ 0,075 M
Vì lượng nước cho quá trình điện ly là quá lớn nên coi như lượng nước không thay đổi và có nồng độ bằng 1
Ta có Kb = 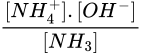 → 1,8. 10-5 =
→ 1,8. 10-5 = 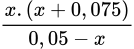 → x = 1,199. 10-5
→ x = 1,199. 10-5
→ pH = 14+ log(1,199. 10-5) = 9,07 ≈ 9,1. Đáp án A.
Số bình luận về đáp án: 7
Có nHCl = 0,003 mol < nNH3 = 0,005 mol → dung dịch sau phản ứng chứa NH3 dư : 0,005 - 0,003= 0,002 mol → [NH3]dư = 0,002 : ( 0,025 + 0,015) = 0,05 M
Bài toán trở thành tính pH của dung dịch chứa NH3 : 0,05M và NH4Cl : 0,075M.
NH3 + H2O
 NH4+ + OH- có Kb = 1,8. 10-5.
NH4+ + OH- có Kb = 1,8. 10-5.Gọi nồng độ OH- là x →[OH-] = x M, [NH3] = 0,05-x , [NH4+] = x +
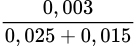 = x+ 0,075 M
= x+ 0,075 MVì lượng nước cho quá trình điện ly là quá lớn nên coi như lượng nước không thay đổi và có nồng độ bằng 1
Ta có Kb =
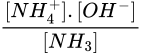 → 1,8. 10-5 =
→ 1,8. 10-5 = 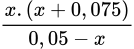 → x = 1,199. 10-5
→ x = 1,199. 10-5 → pH = 14+ log(1,199. 10-5) = 9,07 ≈ 9,1. Đáp án A.