Trong quá trình Haber, ammonia được sản xuất theo phương trình hoá học sau:
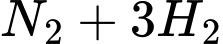
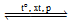
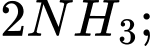
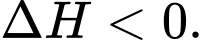
a) Sử dụng nguyên lí Le Chatelier’s cho biết hiệu suất tổng hợp ammonia sẽ thay đổi như thế nào khi tăng áp suất của hệ cân bằng này ở nhiệt độ không đổi.
b) Nêu lí do tại sao trong ngành công nghiệp sử dụng áp suất 200 bar mặc dù hiệu suất tổng hợp ammonia cao hơn nếu dùng áp suất cao hơn.
-
-
-
-
Đáp án đúng:
a) 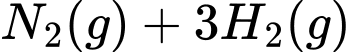
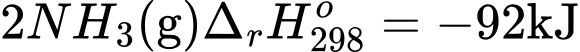
4
2
- Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí => chuyển dịch theo chiều thuận, lượng 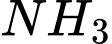 tăng nên hiệu suất tăng.
tăng nên hiệu suất tăng.
b) Khi áp suất tăng, hiệu suất tổng hợp ammonia tăng. Tuy nhiên, trong thực tế người ta thường duy trì áp suất ở 200 bar vì:
+ Chi phí đầu tư thiết bị tổng hợp ở áp suất cao hơn rất tốn kém.
+ Lượng 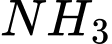 (hay hiệu suất tổng hợp NH3) tăng không đủ chi phí bù cho đầu tư thiết bị tổng hợp.
(hay hiệu suất tổng hợp NH3) tăng không đủ chi phí bù cho đầu tư thiết bị tổng hợp.
Vì vậy, áp suất 200 bar là sự "thoả hiệp" hợp lí để cân đối giữa lợi ích kinh tế và các điều kiện phản ứng tối ưu.
Số bình luận về đáp án: 0
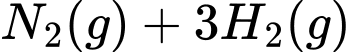
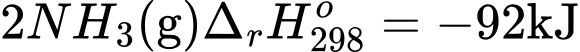
4 2
- Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí => chuyển dịch theo chiều thuận, lượng
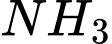 tăng nên hiệu suất tăng.
tăng nên hiệu suất tăng. b) Khi áp suất tăng, hiệu suất tổng hợp ammonia tăng. Tuy nhiên, trong thực tế người ta thường duy trì áp suất ở 200 bar vì:
+ Chi phí đầu tư thiết bị tổng hợp ở áp suất cao hơn rất tốn kém.
+ Lượng
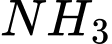 (hay hiệu suất tổng hợp NH3) tăng không đủ chi phí bù cho đầu tư thiết bị tổng hợp.
(hay hiệu suất tổng hợp NH3) tăng không đủ chi phí bù cho đầu tư thiết bị tổng hợp. Vì vậy, áp suất 200 bar là sự "thoả hiệp" hợp lí để cân đối giữa lợi ích kinh tế và các điều kiện phản ứng tối ưu.