Trong quá trình sản xuất sulfuric acid, sulfur dioxide được chuyển thành sulfur trioxide ở nhiệt độ 400 – 500°C theo phản ứng:
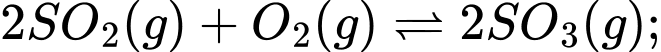
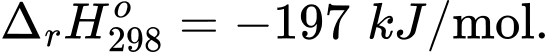
a) Nêu tác động khi tăng áp suất với tốc độ phản ứng và hiệu suất phản ứng.
b) Trong thực tế, quá trình trên thường được thực hiện ở áp suất khí quyển. Đề xuất một lý do giải thích.
c) Trong quá trình này, sulfur trioxide được loại bỏ khỏi hỗn hợp phản ứng bằng cách chuyển nó thành sulfuric acid. Các khí còn lại sau đó được đưa trở lại bình phản ứng. Giải thích lý do tái sử dụng khí.
d) Những yếu tố nào sẽ ảnh hưởng đến việc lựa chọn nhiệt độ phản ứng?
-
-
-
-
Đáp án đúng:
a)
- Áp suất tăng → tốc độ phản ứng tăng
- Phản ứng thuận làm giảm số mol khí → khi tăng áp suất cân bằng chuyển dịch chiều thuận → làm tăng hiệu suất phản ứng.
b) Trong thực tế, có thể thu được sulfur trioxide với hiệu suất cao (98%) mà không cần sử dụng áp suất cao → việc tốn nhiều chi phí đầu tư thiết bị tăng áp suất tốn kém mà hiệu suất tăng không đáng kể.
c) Theo nguyên lí Le Châtelier’s, giảm nồng độ SO3 sẽ làm cân bằng chuyển dịch sang phải → hiệu suất tổng hợp tăng.
Việc tái sử dụng khí để giảm thiểu phát thải sulfur dioxide, là chất gây ô nhiễm môi trường, gây mưa acid.
d) Cân nhắc giữa tốc độ phản ứng và độ lớn của hằng số cân bằng Kc.
Số bình luận về đáp án: 0
- Áp suất tăng → tốc độ phản ứng tăng
- Phản ứng thuận làm giảm số mol khí → khi tăng áp suất cân bằng chuyển dịch chiều thuận → làm tăng hiệu suất phản ứng.
b) Trong thực tế, có thể thu được sulfur trioxide với hiệu suất cao (98%) mà không cần sử dụng áp suất cao → việc tốn nhiều chi phí đầu tư thiết bị tăng áp suất tốn kém mà hiệu suất tăng không đáng kể.
c) Theo nguyên lí Le Châtelier’s, giảm nồng độ SO3 sẽ làm cân bằng chuyển dịch sang phải → hiệu suất tổng hợp tăng.
Việc tái sử dụng khí để giảm thiểu phát thải sulfur dioxide, là chất gây ô nhiễm môi trường, gây mưa acid.
d) Cân nhắc giữa tốc độ phản ứng và độ lớn của hằng số cân bằng Kc.