Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F2, H2, HF, CH4, NF3, KBr. (Cho số hiệu nguyên tử của F = 9 , H = 1, C = 6, N = 7, K = 19 và Br = 35).
-
-
-
-
Đáp án đúng:
* Sự tạo thành phân tử F2
+ 9F: 1s22s22p5 => Xu hướng của fluorine khi hình thành liên kết hoá học là nhận thêm 1 electron đạt cấu hình bền của khí hiếm.
Khi hình thành liên kết trong phân tử F2 mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền vững của khí hiếm Ne.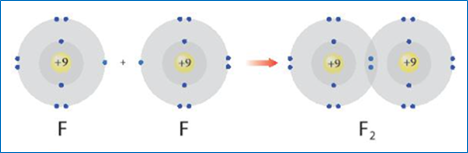
* Sự tạo thành phân tử H2
+ 1H: 1s1 => Khi hình thành liên kết trong phân tử H2 mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Helium.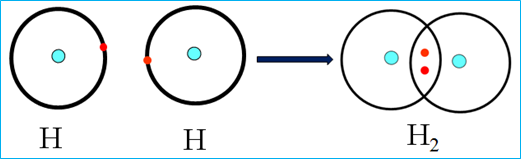
* Sự tạo thành phân tử HF
+ HF => Khi hình thành liên kết trong phân tử HF mỗi nguyên tử fluorine và hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne và He gần nó nhất.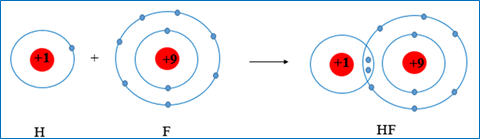
* Sự tạo thành phân tử CH4
+ 6C: 1s22s22p2
+ 1H: 1s1
⇒ Khi hình thành liên kết trong phân tử CH4 nguyên tử carbon có xu hướng góp chung 4 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm He gần nó nhất.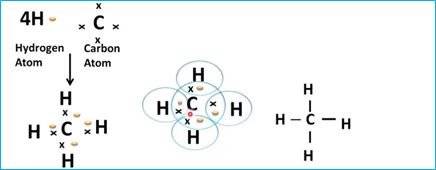
* Phân tử NF3
+ 7N: 1s22s22p3
9F: 1s22s22p5
=> Khi hình thành liên kết trong phân tử NF3 mỗi nguyên tử nitrogen có xu hướng góp chung 3 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne gần nó nhất.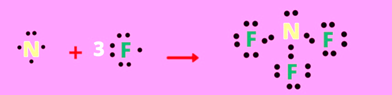
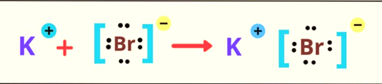
*Phân tử KBr
+ 19K:
1s22s22p63s23p64s1 => Xu hướng cơ bản của nguyên tử potassium khi hình thành liên kết hoá học là nhường đi 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm Argon.
+ 35Br: 1s22s22p63s23p63d104s24p5 => Xu hướng cơ bản của nguyên tử bromine khi hình thành liên kết hoá học là nhận vào 1 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất.
Số bình luận về đáp án: 0
+ 9F: 1s22s22p5 => Xu hướng của fluorine khi hình thành liên kết hoá học là nhận thêm 1 electron đạt cấu hình bền của khí hiếm.
Khi hình thành liên kết trong phân tử F2 mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền vững của khí hiếm Ne.

* Sự tạo thành phân tử H2
+ 1H: 1s1 => Khi hình thành liên kết trong phân tử H2 mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Helium.

* Sự tạo thành phân tử HF
+ HF => Khi hình thành liên kết trong phân tử HF mỗi nguyên tử fluorine và hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne và He gần nó nhất.

* Sự tạo thành phân tử CH4
+ 6C: 1s22s22p2
+ 1H: 1s1
⇒ Khi hình thành liên kết trong phân tử CH4 nguyên tử carbon có xu hướng góp chung 4 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử hydrogen có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm He gần nó nhất.

* Phân tử NF3
+ 7N: 1s22s22p3
9F: 1s22s22p5
=> Khi hình thành liên kết trong phân tử NF3 mỗi nguyên tử nitrogen có xu hướng góp chung 3 electron để đạt cấu hình bền của khí hiếm Ne và mỗi nguyên tử fluorine có xu hướng góp chung 1 electron để đạt cấu hình bền của khí hiếm Ne gần nó nhất.

*Phân tử KBr
+ 19K:
1s22s22p63s23p64s1 => Xu hướng cơ bản của nguyên tử potassium khi hình thành liên kết hoá học là nhường đi 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm Argon.
+ 35Br: 1s22s22p63s23p63d104s24p5 => Xu hướng cơ bản của nguyên tử bromine khi hình thành liên kết hoá học là nhận vào 1 electron để đạt cấu hình bền vững của khí hiếm gần nó nhất.
