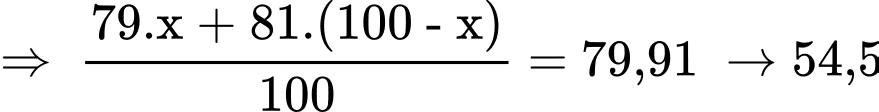X là một nguyên tố có nhiều ứng dụng. Các hợp chất của X được sử dụng trong công nghiệp dược phẩm, sản xuất thuốc nhuộm, mực in và làm thuốc “hiện hình” trong nghề ảnh, khoan dầu. Ở trạng thái cơ bản, nguyên tử nguyên tố X có 17 electron thuộc các phân lớp p.
a) Viết cấu hình electron của X.
b) X có hai đồng vị hơn kém nhau hai neutron. Trong đồng vị có số khối lớn hơn, số hạt không mang điện bằng 23/35 lần hạt mang điện. Xác định thành phần cấu tạo của hai đồng vị và thành phần phần trăm số nguyên tử của mỗi đồng vị, biết nguyên tử khối trung bình của X bằng 79,91. Coi NTK có giá trị xấp xỉ bằng số khối.
-
-
-
-
Đáp án đúng:
a) Vì X có 17 electron thuộc phân lớp p
=> cấu hình electron phân lớp p của X là: 2p63p64p5
=> cấu hình electron đầy đủ: 1s22s22p63s23p63d104s24p5. (Bromine).
b) Trong đồng vị số khối lớn số hạt mang điện là 35.2 = 70 hạt
=> số neutron (hạt không mang điện) là (23/35).70 = 46 hạt.
=> số neutron trong đồng vị số khối nhỏ là 44 hạt.
Vậy thành phần cấu tạo các đồng vị của X là:
Đồng vị số khối nhỏ: 35 electron, 35 proton, 44 neutron => A = 79.
Đồng vị số khối lớn: 35 electron, 35 proton, 46 neutron => A = 81.
Thành phần %: Gọi thành phần % theo số nguyên tử đồng vị nhỏ là x% => thành phần % theo số nguyên tử đồng vị lớn là (100 – x)%.
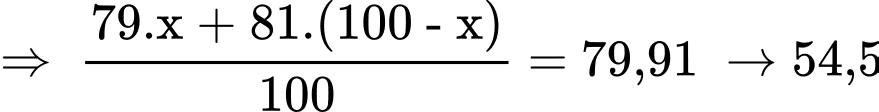 Số bình luận về đáp án: 0
Số bình luận về đáp án: 0
=> cấu hình electron phân lớp p của X là: 2p63p64p5
=> cấu hình electron đầy đủ: 1s22s22p63s23p63d104s24p5. (Bromine).
b) Trong đồng vị số khối lớn số hạt mang điện là 35.2 = 70 hạt
=> số neutron (hạt không mang điện) là (23/35).70 = 46 hạt.
=> số neutron trong đồng vị số khối nhỏ là 44 hạt.
Vậy thành phần cấu tạo các đồng vị của X là:
Đồng vị số khối nhỏ: 35 electron, 35 proton, 44 neutron => A = 79.
Đồng vị số khối lớn: 35 electron, 35 proton, 46 neutron => A = 81.
Thành phần %: Gọi thành phần % theo số nguyên tử đồng vị nhỏ là x% => thành phần % theo số nguyên tử đồng vị lớn là (100 – x)%.